Publié le 27 nov 2014Lecture 7 min
Diabète gestationnel : peut-on sortir des recommandations professionnelles pour la pratique clinique ?
P. DERUELLE, Maternité Jeanne-de-Flandre, CHRU de Lille ; Faculté de médecine Henri Warembourg, Université Lille-2
Proposées fin 2009, les recommandations pour la pratique clinique à propos du diabète gestationnel (DG) ont été largement diffusées en France(1). Cependant, et avec le recul de leur application, un certain nombre d’éléments peuvent être discutés : la définition du DG, le choix du dépistage au premier trimestre, l’augmentation inquiétante de la prévalence, le caractère ciblé ou systématique du dépistage, les modalités du traitement ou encore la place de l’allaitement dans la prise en charge néonatale.
Et HAPO fut publiée !
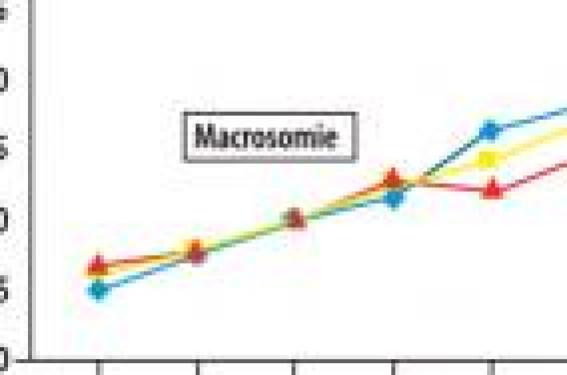
Les modifications les plus importantes concernent les modalités de dépistage qui ont été déterminées à partir de l’étude HAPO (Hyperglycemia and Adverse Pregnancy Outcome)(2) qui montrait qu’il n’y a pas de seuil de glycémie à jeun (GAJ) ou après charge en glucose associé aux complications du diabète gestationnel (figure 1).
Figure 1. Prévalence de la macrosomie en fonction des valeurs de glycémies
(The HAPO Study Cooperative Research Group. N Engl J Med 2008).
Les critères retenus pour déterminer les seuils diagnostiques de DG ont été :
– poids de naissance élevé pour l’âge gestationnel ;
– C-peptide au cordon > 90e percentile ;
– pourcentage de masse grasse du nouveau-né > 90e percentile. Les valeurs seuils (GAJ ≥ 0,92 mg/l ; 1 h ≥ 1,80 mg/l ; 2 h ≥ 1,53 mg/l) ont été choisies pour un odds ratio (OR) à 1,75, soit un sur-risque de 75 % de ces complications par rapport à la classe glycémique la plus faible.
La définition choisie pour le diabète gestationnel est-elle adaptée ?
La définition du diabète gestationnel correspond à tout trouble de la tolérance glycémique débutant ou diagnostiqué pour la première fois pendant la grossesse. Cette définition est mondialement reconnue puisque c’est celle qui a été proposée par l’Organisation mondiale de la santé. Cependant, cette définition est insuffisante puisqu’elle inclut des groupes de patientes dont les caractéristiques cliniques sont différentes (figure 2).
Figure 2. Représentation des différentes catégories de patientes
présentant un diabète au cours de la grossesse.
Ainsi, les patientes avec une valeur anormale lors de la réalisation d’une hyperglycémie provoquée par voie orale correspondent au diabète gestationnel en lien avec l’apparition d’une insulino-résistance à partir du 2e trimestre de la grossesse. Les patientes qui ont, au 1er trimestre, une glycémie à jeun entre 0,92 et 1,26 g/l sont étiquetées « diabète gestationnel », alors qu’en réalité, elles ont un trouble de la tolérance glucidique, probablement une hyperglycémie à jeun, qui persistera après la grossesse. Au total, l’élaboration des RPC sur le diabète gestationnel aurait pu être l’occasion d’une plus grande précision dans la définition des catégories de patientes présentant un trouble de la tolérance glucidique.
Une augmentation inquiétante de la prévalence du diabète gestationnel ?
La prévalence du DG est variable en fonction de la population (encadré).
Depuis 20 ans, cette prévalence est en augmentation en raison de la plus grande fréquence du surpoids et de l’obésité (sédentarité, « malbouffe »), de l’âge maternel plus avancé. L’application des nouveaux critères de dépistage fait craindre une augmentation du nombre de patientes à prendre en charge. Afin d’évaluer l’impact des nouvelles recommandations, nous avons mené une étude prospective dont l’objectif principal était d’estimer la prévalence du diabète gestationnel selon les nouveaux critères. Le dépistage était effectué systématiquement entre 24 et 28 SA par une HGPO avec 75 g de glucose. Les valeurs seuils choisies pour définir le DG étaient celles définies par les RPC. L’application des nouveaux critères augmente de façon importante le taux de patientes avec un diabète gestationnel, qui atteint 14 % (figure 2).
Ces résultats sont surprenants. En effet, quelles sont ces patientes méconnues comme porteuses d’un DG avant les RPC ? Le choix de la macrosomie définie comme un poids de naissance comme critère de définition a-t-il du sens au regard des données actuellement disponibles dans la littérature ? Ces questions devront faire l’objet d’études cliniques ultérieures.
Une seule valeur de glycémie ≥ 0,92 mg/l est-elle suffisante pour parler de diabète gestationnel ?
Au 1er trimestre, après accord professionnel, il a été choisi de retenir une glycémie à jeun ≥ 1,26 g/l pour le diagnostic de DT2 et une glycémie à jeun ≥ 0,92 g/l et < 1,26 g/l pour le DG. Ce choix de la valeur de la glycémie à jeun s’est appuyé sur les données d’une seule étude rétrospective suédoise(3) qui avait montré des valeurs similaires de glycémies à jeun à 17 comme à 32 semaines d’aménorrhée (figure 3).
Figure 3. Évolution de la prévalence du diabète gestationnel avant/après application
des nouveaux critères de dépistage selon les RPC 2009.
La valeur seuil de glycémie à jeun (0,92 mg/l) choisie pour le dépistage entre 24 et 28 SA a donc ainsi été extrapolée pour définir la valeur seuil de glycémie à jeun pour le premier trimestre. Cependant, ce choix comporte certaines limites. Alors que pour le diagnostic du diabète, il est nécessaire d’avoir confirmation des valeurs élevées par deux prélèvements successifs, en cas de grossesse, un seul dosage permet le diagnostic.
Un contrôle pourrait être utile pour vérifier la valeur mesurée la première fois. Il n’existe pas d’étude prospective ayant évalué le seuil de normalité en début de grossesse. De même, il n’existe pas de données sur la prise en charge de cette population. L’intérêt de dépister des patientes avec un diabète de type 2 méconnu n’est pas discutable. En revanche, celui de dépister cette population particulière de patientes avec une hyperglycémie à jeun, qualifiées comme porteuses d’un DG, reste à démontrer.
Dépistage ciblé ou systématique ?
Un dépistage ciblé a été recommandé en présence d’au moins l’un des facteurs suivant :
– âge ≥ 35 ans ;
– IMC ≥ 25 kg/m² ;
– ATCD familiaux au 1er degré de diabète ;
– ATCD de DG ou d’enfant macrosome lors d’une grossesse précédente.
Ces éléments se justifiaient en raison de l’absence de données formelles montrant une amélioration du pronostic du traitement du diabète gestationnel en l’absence de facteurs de risque et devant la crainte d’une forte augmentation de la prévalence de DG avec les nouveaux critères. Ainsi, un dépistage ciblé permettrait d’exempter du dépistage 5 à 85 % des femmes en fonction des facteurs de risque choisis et de leur prévalence ainsi que du niveau des seuils. Cependant, l’utilisation du dépistage ciblé pose le problème des cas de DG méconnus dont la proportion est estimée entre 3 à 10 % mais peut atteindre 30 %, voire 50 % dans certaines séries.
La nulliparité, la méconnaissance des antécédents familiaux et la qualité de l’interrogatoire sont les éléments qui expliquent le mieux cette mise en défaut. Cosson et coll. ont repris les données de 18 775 grossesses avec facteurs de risque connus en leur appliquant les RPC 2009(4). Ils ont rapporté que la prévalence du DG était de 14,4 % et que 34,7 % des patientes avec un diagnostic de diabète gestationnel n’avaient pas de FDR. Ainsi, ces éléments remettent en question le choix du dépistage ciblé et apportent des arguments aux défenseurs du dépistage universel.
L’insuline, seul traitement médicamenteux du DG ?
Le traitement du DG comporte des règles hygiéno-diététiques et le maintien d’une activité physique adaptée à la grossesse et une insulinothérapie lorsque les objectifs glycémiques ne sont pas atteints. L’utilisation des antidiabétiques oraux n’a pas été recommandée.
Pourtant, les publications concernant la metformine comme le glibenclamide ont rapporté de bons résultats. Les données sur la metformine sont assez robustes, mais cette molécule passe la barrière placentaire et ses effets à long terme sont inconnus. Pour le glibenclamide, les études présentent certaines faiblesses méthodologiques. Ces deux molécules n’ont pas d’AMM, ce qui a été le facteur limitant principal.
Un travail multicentrique coordonné par le Pr Sénat (INDAO) est actuellement mené pour comparer glibenclamide et insuline. Il est possible que ses résultats viennent bouleverser la prise en charge du DG.
Et le nouveau-né ?
Dans les RPC, il est indiqué que les enfants nés de mère ayant eu un DG constituent une population à risque modéré de complications métaboliques à long terme. Cependant, les RPC n’ont pas proposé de prise en charge concrète. L’intérêt de l’allaitement maternel n’a pas été souligné.
En effet, les études cliniques qui se sont intéressées à l’allaitement chez les mères avec un DG manquent de puissance statistique, mais certaines données expérimentales montrent un effet bénéfique.
De plus, chez les mères non diabétiques, l’allaitement a démontré son effet protecteur à long terme contre l’apparition d’un syndrome métabolique chez leurs enfants. Il est vraisemblable que les RPC auraient pu être plus informatives, rappelant les bienfaits de l’allaitement.
Conclusion
On peut considérer que les données antérieurement publiées sur l’efficacité de la prise en charge du DG sont maintenant appliquées à une « nouvelle population » définie par de nouveaux critères diagnostiques. Il existe actuellement peu d’études de ces patientes et l’intérêt de la prise en charge du DG sur cette population plus large doit faire l’objet d’une évaluation.
En effet, l’augmentation de la prévalence peut faire craindre un effet de « dilution », rendant plus difficile la démonstration d’une amélioration du devenir maternel et néonatal ou d’un intérêt médico-économique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


