Imagerie
Publié le 24 nov 2020Lecture 16 min
L’échographie Doppler en obstétrique au 2e et 3e trimestre – Un outil pour le dépistage, le diagnostic et la surveillance du retard de croissance intra-utérin
Sandra LE GARREC Sage-femme échographiste Centre Hospitalier Nord Deux-Sèvres
Quel Doppler ? Quand l’utiliser ? Comment l’interpréter ?
La principale cause de l’altération de la croissance chez un fœtus par ailleurs normal est le dysfonctionnement, ou insuffisance utéro-placentaire. L’échographie Doppler est alors un apport fonctionnel non invasif pour le dépistage, le diagnostic et la surveillance de ces retards de croissance intra-utérins (RCIU). Une croissance altérée est associée à un risque accru de mortalité et de morbidité périnatale avec une issue plus défavorable pour le nourrisson à long terme. Cet examen complémentaire va permettre une meilleure prise en charge de ces situations à risque. Il sera utilisé dans des circonstances précises et avec un objectif précis, car de cet examen va découler une prise en charge obstétricale adaptée : fréquence et type de surveillance, indication de déclenchement ou extraction…
Qu’est-ce que le Doppler ?
L’effet Doppler correspond à une modification de fréquence de l’onde ultrasonore entre l’émission et la réception lorsque la distance entre l’émetteur et le récepteur varie au cours du temps. Ainsi, le faisceau ultrasonore est émis par la sonde de l’échographe a une fréquence donnée et est renvoyé par les éléments figurés du sang à une fréquence différente. C’est cette différence de fréquence qui va nous permettre de savoir dans quel sens et à quelle vitesse circulent les hématies.
En pratique quotidienne, nous utilisons principalement le Doppler pulsé et le Doppler couleur. Le Doppler couleur permet souvent de localiser le flux à étudier et le Doppler pulsé permet, lui, d’effectuer le « tir » Doppler. C’est le spectre retranscrit par le Doppler pulsé que nous allons analyser ci-dessous.
Le Doppler utérin ou Doppler des artères utérines (DAU)
Les artères utérines naissent de l’artère iliaque interne et remontent latéralement le long du corps de l’utérus.
Le Doppler utérin cherche à évaluer l’apport sanguin au niveau de l’utérus afin d’explorer la circulation utéro-placentaire. Il a pour but de dépister ou diagnostiquer les anomalies placentaires vasculaires qui peuvent être à l’origine de RCIU d’origine vasculaire maternelle.
Physiopathologie
La placentation est caractérisée par un processus d’invasion de la partie superficielle de l’utérus par les cellules du cytotrophoblaste extravilleux. Cette invasion trophoblastique est orientée vers les artères spiralées de l’utérus. Cette prolifération des cytotrophoblastes donne lieu à une première vague d’invasion de l’endomètre et des artères spiralées avant 12 semaines d’aménorrhée (SA). Une deuxième vague d’invasion survient vers 16 à 20 SA. Cela entraîne une disparition de la tunique musculaire lisse de la paroi artérielle et des cellules endothéliales maternelles. La tunique de l’artère devient alors atone et insensible aux éléments vasoactifs permettant une perfusion facilitée de la chambre intervilleuse. Ainsi, il y a une augmentation importante du débit sanguin en faveur du placenta.
Si le processus d’invasion s’arrête, la deuxième vague d’invasion trophoblastique n’ayant pas lieu, les résistances périphériques sont conservées, laissant une circulation à haute résistance. Il y a alors une diminution de la vascularisation du lit placentaire par les artères utérines.
Au premier trimestre de la grossesse, le DAU va permettre de dépister les populations à haut risque de complications vasculaires pour lesquelles l’instauration d’un traitement par aspirine aurait un intérêt bénéfique.
Au deuxième et troisième trimestres, l’étude du DAU en population générale est décevante. Cependant, dans une population à haut risque, comme lors de la survenue d’une pré-éclampsie, elle permet de repérer les fœtus à haut risque de survenue de RCIU. Il a aussi un intérêt diagnostique dans le bilan étiologique d’un RCIU.
Ainsi, on définit un spectre pathologique sur le Doppler des artères utérines par un index de résistance élevé et/ou la présence d’un notch (incisure proto-diatolique). Notons que le notch peut être physiologique jusqu’à 24-26 SA et qu’il est nécessaire de contrôler sa disparition.
La particularité du Doppler utérin est qu’il existe 2 artères concernées. Ainsi, plusieurs critères permettent d’établir une échelle de gravité : Altération du Doppler uni- ou bilatéral, du côté placentaire ou opposé, avec un index élevé ou non et la présence de notch, ainsi que sa profondeur.
Cette augmentation des résistances périphériques va donc pouvoir avoir des conséquences cliniques à type de RCIU par insuffisance placentaire. Cela n’est évidemment pas un argument diagnostique. Cependant, associé à l’étude des indices Doppler ombilical et cérébral, du volume amniotique, de l’examen clinique et biologique maternel, il permet de rechercher des arguments en faveur d’une origine placentaire.
La technique de mesure
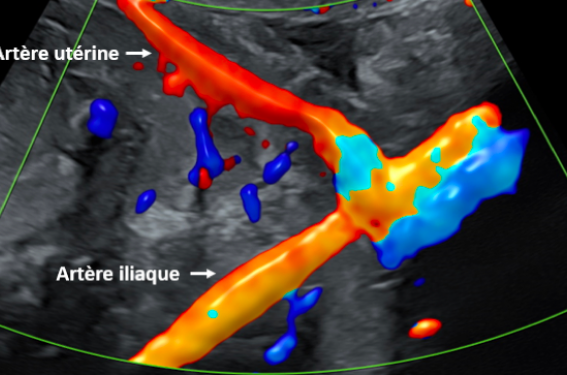
Le recueil du signal Doppler est réalisé au niveau du tronc principal de l’artère utérine (qui correspond à la résultante des résistances des artères spiralées et arquées). L’artère utérine est facilement repérable grâce au mode Doppler couleur en temps réel car le tronc principal de l’artère utérine croise l’artère iliaque externe (qui chemine le long de l’isthme utérin) (figure 1).
La mesure peut être réalisée par voie vaginale ou abdominale sur les 2 artères utérines sur au moins 3 cycles. En abdominal, la sonde est placée à 2 à 3 cm en dedans des épines iliaques antéro-supérieures, face orientée vers l’utérus. L’axe de tir doit être le plus possible dans l’alignement du flux sanguin, c’est-à-dire que le plus tangentiel possible à l’axe tir.
Figure 1. Repérage du tronc principal de l’artère utérine en Doppler couleur par voie abdominale.
Analyse du spectre
L’analyse du spectre du Doppler pulsé de l’artère utérine pourra être effectuée de façon :
Quantitative : avec les indices de résistance IR ou de pulsatilité IP.
Pour comprendre ces indices, il faut décomposer le tracé de l’enregistrement Doppler (figure 2) :
– S correspond à la systole cardiaque et traduit la puissance d’éjection
– D correspond à la diastole cardiaque et traduit la résistance circulatoire.
À partir de là, on va pouvoir calculer ces indices. Le plus fréquemment utilisé c’est l’index de résistance IR = S-D/S. Ce ratio nous donne un chiffre sans unité.
Visuellement, plus la diastole est basse, plus l’index de résistance va être élevé.
Le spectre en lui-même traduit des vitesses en cm.s-1.
Figure 2. Représentation schématique d’un spectre Doppler pulsé normal dans une artère utérine.
Qualitative : présence ou absence d’une incisure protodiastoloque appelée couramment notch (figure 3).
Figure 3. Représentation schématique d’un notch sur un spectre Doppler pulsé dans une artère utérine.
Spectre normal
Le pic systolique présente une phase ascendante verticale, suivi d’une phase descendante rapide puis une deuxième phase descendante moins rapide. Pour que le spectre soit normal, il faut en général un flux résiduel en diastole d’environ 40 % (figure 4).
Figure 4. Doppler de l’artère utérine : spectre normal.
Spectre pathologique
Quantitatif : Diminution de la diastole avec une augmentation de l’IR et de l’IP.
Le spectre pathologique est caractérisé par une diminution de la diastole par rapport à la systole, le 95e percentile correspondant à un IR= D/S à 22-24SA entre 35 et 40 % (figure 5).
Figure 5. Doppler de l’artère utérine avec une diastole basse.
Qualitatif : Existence d’une incisure protodiastolique, cassure au niveau du deuxième changement de pente révélant la persistance de l’élasticité de la paroi des vaisseaux et d’un reflux sanguin diastolique (figure 6).
Figure 6. Doppler de l’artère utérine avec un notch et une diastole basse.
Doppler de l’artère ombilicale (Doppler ombilical : DO)
Il évalue les flux au niveau des artères ombilicales qui ramènent le sang désoxygéné au placenta.
Physiopathologie
En situation pathologique, le plus souvent dysgravidique, les résistances placentaires augmentent du fait de la présence de microthrombi et d’infarctus diffus. On observe alors une diminution anormale du flux diastolique ombilical, d’autant plus importante que les altérations placentaires sont étendues. L’augmentation de ces résistances dans l’artère ombilicale, mesurées au niveau du placenta, sont souvent dues à une pathologie gravidique complexe à point de départ placentaire.
Dans les situations de RCIU, le DO nous donne une évaluation pronostique de la gravité car il renseigne directement sur l’état fœtal, c’est un marqueur fiable de souffrance fœtale chronique. Il est le reflet des résistances vasculaires placentaires et se trouve influencé par l’insuffisance placentaire et le RCIU. Une inversion du flux en diastole signe une souffrance fœtale grave avec acidose ou hypoxie.
Après 26 SA, devant un DAU pathologique ou dans le cadre d’un ATCD de RCIU, un Doppler ombilical pathologique précède l’infléchissement des biométries fœtales. Il a donc un intérêt majeur pour différencier les petits poids pour l’âge gestationnel (PAG) constitutionnels à Doppler ombilical normal avec potentiel de croissance conservé, des fœtus à risque d’hypoxie chronique à Doppler ombilical pathologique. Enfin, il est essentiel dans la surveillance du bien-être fœtal dans le cadre des RCIU.
Technique de mesure
Le cordon est très facilement repéré en mode 2D puis avec le Doppler couleur (figure 7). L’insertion du cordon sur la plaque choriale est le site de mesure préférentiel car la mobilité du cordon y est moindre et les flux observés reflètent uniquement les résistances placentaires. Il existe une différence significative dans les indices Dopplers des artères ombilicales en fonction du site de mesure : au niveau de l’ombilic fœtal, du cordon libre et de l'extrémité placentaire du cordon. La résistance sera plus élevée au niveau de l’extrémité fœtale du cordon. En cas de grossesses multiples par contre, les enregistrements en intra-abdominale fœtal sont à privilégier afin d’éviter des erreurs d’identification de fœtus (figure 8). De plus, les mesures étant répétées dans le temps, la fiabilité comparative sera augmentée.
Le spectre Doppler obtenu est de type basse résistance. Les deux artères ombilicales peuvent être explorées indifféremment. Pour avoir un spectre satisfaisant, il convient d’avoir un angle inférieur à 30° entre le flux de l’artère et l’axe de tir Doppler.
Figure 7. Repérage des artères ombilicales au niveau de l’insertion placentaire en Doppler couleur.
Figure 8. Repérage des artères ombilicales, en intra-abdominal dans le cadre d’une grossesse gémellaire, en Doppler couleur.
Analyse du spectre
Au cours de la grossesse, la résistance placentaire diminue progressivement et le flux diastolique ombilical augmente parallèlement. La mesure semi-quantitative de l’index de résistance ombilical IR est exprimée par le rapport (S-D)/S et diminue aussi progressivement au cours de la grossesse. Visuellement, moins la diastole est élevée, plus l’index de résistance va être élevé.
Spectre normal
Le pic systolique présente une phase ascendante verticale, suivi d’une phase décroissante longue. La diastole représente au maximum 30 à 40 % de la hauteur du flux en systole. L’aspect est celui d’un vaisseau affecté à un organe à basse résistance, le placenta. L’index le plus utilisé reste l’index de résistance (IR) comme pour le DAU (figures 9 et 10).
Figure 9. Représentation schématique d’un spectre Doppler pulsé normal dans une artère ombilicale.
Figure 10. Doppler de l’artère ombilicale : spectre normal.
Spectre pathologique
Le pic systolique est identique mais phase de décroissance conduit à une diminution de la diastole qui peut progressivement devenir nul ou s’inverser, c’est le reverse flow. Dans ces deux derniers cas, l’IR ne peut plus être quantifier, l’indice de pulsatilité (IP) IP = (D-S)/m (m étant la vitesse moyenne) peut continuer à être calculé, contrairement à l’IR, et permettre un suivi longitudinal (figures 11 à 16).
Figure 11. Représentation schématique d’un spectre Doppler pulsé avec une diastole basse dans une artère ombilicale.
Figure 12. Doppler de l’artère ombilicale avec une diastole basse.
Figure 13. Représentation schématique d’un spectre Doppler pulsé avec une diastole nulle dans une artère ombilicale.
Figure 14. Doppler de l’artère ombilicale avec une diastole quasi nulle.
Figure 15. Représentation schématique d’un spectre Doppler pulsé avec un reverse flow dans une artère ombilicale.
Figure 16. Doppler de l’artère utérine avec un reverse flow.
Le spectre pathologique du Doppler de l’artère ombilicale va permettre de repérer les fœtus à haut risque périnatal. Ainsi, le Doppler ombilical permet d’adapter la surveillance des grossesses à risque. Elle sera allégée en cas de spectre normal et renforcée en cas de spectre pathologique, celle-ci pouvant aller jusqu’à une décision d’extraction fœtale.
Doppler cérébral (Doppler : ACM)
Le Doppler des artères cérébrales possède une valeur diagnostique élevée pour la souffrance fœtale dans une population à très haut risque. Ainsi, son utilisation s’adresse à une population sélectionnée à risque d’hypoxie fœtale, de RCIU, avec un Doppler ombilical montrant des résistances élevées, une diastole nulle ou un reverse flow. Il existe une corrélation importante entre le degré d’acidose et d’hypoxie, et un Doppler cérébral pathologique.
Physiopathologie
En situation « normale », un flux diastolique cérébrale apparaît vers 25 SA pour augmenter progressivement jusqu’en fin de grossesse.
En cas d’hypoxie fœtale chronique, lorsque les résistances placentaires et ombilicales sont élevées, il a été mis en évidence des modifications hémodynamiques chez le fœtus aboutissant à la redistribution de la circulation sanguine périphérique des extrémités, du tube digestif, des reins et des surrénales vers les organes « nobles » que sont le cœur et le cerveau. Cela entraîne une augmentation du débit cérébral par le biais d’une vasodilatation de ces vaisseaux. Cette vasodilatation d’adaptation se traduit par une augmentation anormale du flux diastolique artériel cérébral. Ce phénomène appelé « épargne cérébrale » permettrait de dépister les fœtus à risque avant la survenue d’anomalies du rythme cardiaque fœtal, témoin de l’hypoxie cérébrale.
Technique de mesure
L’enregistrement du spectre Doppler de l’ACM s’effectue sur une coupe axiale du pôle céphalique fœtal incluant les thalami et la cavité septale (figure 17). Cette coupe se trouve juste en dessous de la coupe du diamètre bipariétal (BIP). Le polygone de Willis est alors visualisable en Doppler couleur, et l’artère cérébrale moyenne ou artère sylvienne a été choisie comme site de mesure car elle est le plus souvent enregistrée du fait d’une orientation favorable par rapport au tir Doppler. La fenêtre du tir Doppler pulsé est placé entre 2 mm et 2 cm de l’origine de l’ACM avec un angle d’insonation < 30°. Le fœtus doit être en phase de repos et la pression sur le mobile fœtal ne doit pas être trop importante.
Il est recommandé d’effectuer la mesure sur un spectre Doppler d’au moins 5 cycles.
Dans la pratique courante, on utilise les indices de résistance et de pulsatilité comme pour les Dopplers précédents.
Figure 17. Repérage de l’artère cérébrale moyenne au niveau du polygone de Willis en Doppler couleur.
Analyse du spectre
Spectre normal
(La représentation schématique de spectre normal de l’ACM est le même que celui du spectre pathologique du DO : cf figure 11).
La vitesse maximale en systole est élevée, la vitesse diminue régulièrement du début à la fin de la diastole avec des vitesses très basses en télédiastole (figure 18).
Figure 18. Doppler de l’artère cérébrale moyenne : spectre normal.
Spectre pathologique
Le pic systolique est identique avec une vitesse maximale en systole élevée. La vitesse diminue régulièrement mais phase de décroissance conduit à une diastole élevée.
(La représentation schématique de spectre pathologique de l’ACM est le même que celui du spectre normal du DO : cf figure 9.)
Une mesure pathologique est représentée par une augmentation de la composante diastolique. L’IR, comme l’IP, est alors diminué. Le spectre Doppler devient à basse résistance (figure 19).
Figure 19. Doppler de l’artère cérébrale moyenne avec une diastole haute.
Le fœtus s’adapte à l’hypoxie par une dilatation des artères cérébrales, témoignant d’une souffrance fœtale. Cette réponse permet dans un premier temps d’assurer une oxygénation suffisante au cerveau fœtal. C’est une adaptation qui correspond à une redistribution du sang oxygéné vers les organes vitaux et permet le maintien d’une oxygénation normale à court terme de ces organes. Un spectre Doppler cérébrale pathologique est prédictif d’hypoxie fœtale aigue à court terme.
Doppler veineux du canal d’Arantius (Ductus Venosus : DV)
La vasodilatation des artères cérébrales fœtales chez le RCIU permet de définir l’adaptation du fœtus à l’hypoxie. Cependant, cette vasodilatation maximale est obtenue au moins deux semaines, en moyenne, avant l’apparition des décélérations tardives sur l’enregistrement du rythme cardiaque fœtal (RCF). Cela rend donc la surveillance par échographie Doppler de ces fœtus avec spectres artériels pathologiques inutilisable.
Dans tous les cas, l’analyse du spectre Doppler du canal d’Arantius ne doit se faire qu’après une étude hémodynamique fœtoplacentaire complète.
Physiopathologie
Les ¾ du sang oxygéné venant de la veine ombilicale sont dirigé via le sinus porte vers le foie qui est un gros consommateur d’oxygène. Le quart restant passe directement de la veine ombilicale (VO) à la veine cave inférieure (VCI) via un shunt in utero le canal d’Arantius ou Ductus Venosus. En situation d’hypoxie, ce sang oxygéné est orienté préférentiellement vers ce DV. Cela permet un remplissage plus rapide de l’oreillette droite et un passage prioritaire à travers le foramen ovale vers l’oreillette gauche, ce qui favorise l’oxygénation du cœur et du cerveau. La détérioration des indices Doppler veineux survient tardivement et est responsable d’une augmentation de la mortalité périnatale.
La technique de mesure
La mesure peut se faire en coupe para sagittale ou en coupe axiale. Dans les deux cas, le repérage de la veine ombilicale et la veine portale gauche va permettre de visualiser le DV qui se trouve dans le prolongement.
En coupe para sagittale, le DV va être visualisé entre la veine portale gauche et la VCI (figure 20).
En coupe axiale, l’origine du DV se trouve dans le prolongement de la VO et de la veine portale gauche, juste avant qu’elle ne tourne vers la droite et conflue vers le sinus porte (figure 21).
Le Doppler couleur indique des vitesses élevées entrainant un aliasing qui va permettre de le repérer facilement. Le tir Doppler doit être réalisé au niveau de la portion naissante du DV, là où les vélocités sont maximales.
L’analyse du spectre se fera sur un enregistrement Doppler d’au moins 5 cycles consécutifs identiques.
Figure 20. Repérage du canal d’Arantius en Doppler couleur sur une coupe parasagittale.
Figure 21. Repérage du canal d’Arantius en Doppler couleur sur une coupe axiale.
Analyse du spectre
Il s’agit d’un spectre veineux avec un aspect en « M », triphasique. La systole ventriculaire S, correspond à la phase de remplissage rapide des oreillettes. La diastole ventriculaire est représentée par l’onde D. L’onde A, correspond à la télédiastole c’est-à-dire à la contraction auriculaire.
Spectre normal
Le spectre Doppler du DV analysé est de manière qualitative. Ainsi le spectre est interprété normal quand l’onde a est positive (figures 22 et 23). Cependant, il est important de ne pas confondre ce spectre du DV avec celui de la VCI ou des veines sus-hépatiques qui ont une onde a physiologiquement négative.
Figure 22. Représentation schématique d’un spectre Doppler pulsé normal du canal d’Arantius.
Figure 23. Doppler veineux du canal d’Arantius : spectre normal.
Spectre pathologique
Un spectre Doppler du canal d’Arantius est considéré comme pathologique lorsque l’onde a est nulle ou négative (figures 24 et 25).
Figure 24. Représentation schématique d’un spectre Doppler pulsé avec une onde a nulle.
Figure 25. Représentation schématique d’un spectre Doppler pulsé avec une onde a négative.
Figure 26. Doppler du canal d’Arantius avec une onde a négative.
La disparition de l’onde a du canal d’Arantius est un indicateur de décompensation fœtale.
Conclusion
L’échographie fonctionnelle avec l’analyse des Dopplers fœtoplacentaires nécessite une rigueur méthodologique avec des indications raisonnées.
Le Doppler doit donc être utilisé de manière efficiente, comme test de dépistage sur une population à risque ou comme test diagnostique ou pronostique en cas de pathologie avérée. L’intérêt obstétrical réside dans prise en charge particulière qui va en découler : expectative, démarche active ou même très active.
La séquence de détérioration des indices Doppler est très souvent progressive : Doppler des artères utérines, Doppler ombilical, Doppler cérébral puis Doppler veineux. Cependant, cette chronologie n’est pas toujours respectée ou prévisible. De même, les anomalies d’enregistrement du RCF ne surviennent pas forcement après les altérations Doppler.
Ainsi, l’intérêt du Doppler en obstétrique permet de prendre en charge notamment les RCIU d’origine vasculaire qui sont à haut risque de morbidité et mortalité périnatale.
L’échographie Doppler a aussi d’autres intérêts spécifiques que nous n’avons pas abordé ici comme l’anémie fœtale ou la surveillance des grossesses gémellaires monochoriales.
L’utilisation du Doppler en obstétrique est utile dans une population à risque, et permet de surveiller et d’adapter la prise en charge des fœtus RCIU à risque augmenté de mortalité périnatale.
Un Doppler des artères utérines (DAU) est pathologique quand les résistances restent élevées, C’est-à-dire avec une diastole basse, et/ou qu’un notch est présent.
Un Doppler ombilical (DO) est pathologique quand les résistances sont élevées, c’est-à-dire avec une diastole nulle ou en reverse flow.
Un Doppler ombilical pathologique entraîne l’analyse Doppler de l’artère cérébrale moyenne (ACM). Celle-ci est pathologique si les résistances sont faibles, avec une diastole élevée, car le fœtus s’adapte à l’hypoxie et privilégie ses organes nobles.
Un Doppler cérébral avec des résistances faibles, entraîne la réalisation d’un Doppler veineux (DV) du canal d’Arantius qui est pathologique lorsque l’onde a devient nulle ou négative.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :